SEL
Sel adalah unit organisasi terkecil yang menjadi dasar kehidupan dalam arti. Semua fungsi kehidupan diatur dan berlangsung di dalam sel. Karena itulah, sel dapat berfungsi secara asalkan seluruh kebutuhan hidupnya terpenuhi.
Sel merupakan kesatuan struktural dan fungsional makhluk hidup, yang mengandung pengertian sebagai penyusun makhluk hidup dan melaksanakan semua fungsi kehidupan (faal tubuh). Berdasar jumlah sel penyusunnya makhluk hidup dapat digolongkan menjadi makhluk hidup uniseluler dan multiseluler. Makhluk hidup multiseluler berasal dari satu sel (zigot) yang kemudian mengalami spesialisasi dan diferensiasi. Struktur sel terdiri dari nukleus (inti sel), sitoplasma beserta organelnya,membran sel dan dinding sel. Sel yang mempunyai fungsi khusus biasanya dilengkapi dengan organel khusus yang tidak ditemukan pada sel lain.
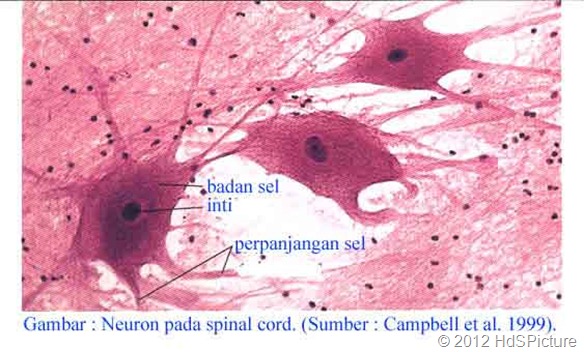 Sel bisa diartikan sebagai gumpalan dari protoplasma yang berinti dan berfungsi sebagai komponen atau alat dalam membantu penyelenggaraan segala aktivitas untuk kebutuhan hidupnya. Selama pertumbuhan, sel akan berubah seiring dengan perkembangannya baik dari bentuk untuk menyesuaikan dengan fungsinya. Bentuk sel bisa epidermis, hal ini akan melindungi sel-sel lain dalam menyimpan persediaan makanan.
Sel bisa diartikan sebagai gumpalan dari protoplasma yang berinti dan berfungsi sebagai komponen atau alat dalam membantu penyelenggaraan segala aktivitas untuk kebutuhan hidupnya. Selama pertumbuhan, sel akan berubah seiring dengan perkembangannya baik dari bentuk untuk menyesuaikan dengan fungsinya. Bentuk sel bisa epidermis, hal ini akan melindungi sel-sel lain dalam menyimpan persediaan makanan.
Sel berasal dari kata cella dimana memiliki arti sekumpulan partikel-partikel yang berukuran kecil dan membentuk suatu kesatuan terkecil dari makhluk hidup agar dapat melaksanakan suatu kehidupan. Pengertian sel sendiri mencakup dari beberapa hal yang berasal dari empat teori yakni unit struktural terkecil dari makhluk hidup, unit fungsional terkecil dari mahkluk hidup, pertumbuhan terkecil dari suatu makhluk hidup, serta unit hereditas terkecil dari mahkluk hidup.
Pengertian Sel Menurut Beberapa Ahli
Sel dilihat pertama oleh Aristoteles (384 – 322 SM). Dia menyatakan bahwa semua makhluk hidup tersusun dari suatu benda hidup atau unit struktural yang mempengaruhi kehidupan suatu organisme. Pada saat ini belum dikenal kata “sel” dari unit structural tersebut.
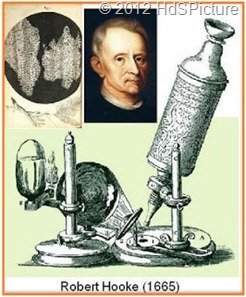 Robert Hooke (1665 M), Dialah orang yang pertama kali yang menamakan unit structural tersebut sebagai “sel”. Beberapa investigator dari tahun 1665 s/d 1831 yang mempelajari sel, Tak satupun yang dapat menyimpulkan bahwa benda hidup tersebut tersusun dari unit atau sel yang serupa.
Robert Hooke (1665 M), Dialah orang yang pertama kali yang menamakan unit structural tersebut sebagai “sel”. Beberapa investigator dari tahun 1665 s/d 1831 yang mempelajari sel, Tak satupun yang dapat menyimpulkan bahwa benda hidup tersebut tersusun dari unit atau sel yang serupa.
Pada tahun 1938 – 1939 M, dua orang ahli biologis yaitu M.J.Schleiden (ahli Botani) dan Theodore Schwann (ahli Zoologi) Mendefinisikan secara jelas tentang sel. Menurut mereka sel adalah unit struktural dan unit fungsional dari organisme hidup.
Sejak tahun 1955, berkembanglah teori sel modern, yaitu:
- Sel adalah unit structural dari makhluk hidup.
- Sel adalah unit fungsionla dari makhluk hidup.
- Sel adalah pembawa sifat dari makhluk
- Sel baru berasal dari sel itu sendiri (pembelahan sel).
- Setiap sel mempunyai aksi dan tugas secara bebas sebagai bagian integral dari organisme lengkap.
Ukuran Sel
- Ukuran dan Bentuk Sel : Ukuran sel biasanya bevariasi antara 10 µm – 100 µm.
- Ukuran sel yang terkecil pada Pleuropneumonia yaitu 0,1 – 0,5 µm.
- Ukuran sel yang terpanjang pada serat Sclerenchymatous pada Boehmenia nevia, yaitu ± 55 cm.
Jumlah Sel
- Protozoa, bakteri, fungi dan alga bersel satu. Mereka disebut sebagai bentuk uniseluler atau aseluler.
- Sebagian besar Kingdom animalia dan Kingdom Plantae dan sebagaian besar Kingdom Fungi terdiri beberapa sel, mereka dikatakan sebagai organisme multiseluler.
Type Sel
Berdasarkan strukturnya, sel terbagi ke dalam dua type, yaitu:
- Sel Prokariotik; yaitu sel dimana mitokondria, kloroplas, dan nucleus tidak terlihat secara jelas. Type sel ini ditemukan pada bakteri dan alga biru hijau yang tergolong dalam kingdom Monera .
- Sel Eukariotik; yaitu sel dimana batas nucleus dan membrane tampak secara jelas. Type sel ini ditemukan pada semua Kingdom Protista , Kingdom Fungi , Kingdom Plantae dan Animalia
2. Sejarah Sel
Penemuan awal
Mikroskop majemuk dengan dua lensa telah ditemukan pada akhir abad ke-16 dan selanjutnya dikembangkan di Belanda, Italia, dan Inggris. Hingga pertengahan abad ke-17 mikroskop sudah memiliki kemampuan perbesaran citra sampai 30 kali. Ilmuwan Inggris Robert Hooke kemudian merancang mikroskop majemuk yang memiliki sumber cahaya sendiri sehingga lebih mudah digunakan. Ia mengamati irisan-irisan tipis gabus melalui mikroskop dan menjabarkan struktur mikroskopik gabus sebagai "berpori-pori seperti sarang lebah tetapi pori-porinya tidak beraturan" dalam makalah yang diterbitkan pada tahun 1665. Hooke menyebut pori-pori itu cells karena mirip dengan sel (bilik kecil) di dalam biara atau penjara. Yang sebenarnya dilihat oleh Hooke adalah dinding sel kosong yang melingkupi sel-sel mati pada gabus yang berasal dari kulit pohon ek. Ia juga mengamati bahwa di dalam tumbuhan hijau terdapat sel yang berisi cairan.
Pada masa yang sama di Belanda, Antony van Leeuwenhoek, seorang pedagang kain, menciptakan mikroskopnya sendiri yang berlensa satu dan menggunakannya untuk mengamati berbagai hal. Ia berhasil melihat sel darah merah, spermatozoid, khamir bersel tunggal, protozoa, dan bahkan bakteri. Pada tahun 1673 ia mulai mengirimkan surat yang memerinci kegiatannya kepada Royal Society, perkumpulan ilmiah Inggris, yang lalu menerbitkannya. Pada salah satu suratnya, Leeuwenhoek menggambarkan sesuatu yang bergerak-gerak di dalam air liur yang diamatinya di bawah mikroskop. Ia menyebutnya diertjen atau dierken (bahasa Belanda: 'hewan kecil', diterjemahkan sebagaianimalcule dalam bahasa Inggris oleh Royal Society), yang diyakini sebagai bakteri oleh ilmuwan modern.
Pada tahun 1675–1679, ilmuwan Italia Marcello Malpighi menjabarkan unit penyusun tumbuhan yang ia sebut utricle ('kantong kecil'). Menurut pengamatannya, setiap rongga tersebut berisi cairan dan dikelilingi oleh dinding yang kokoh. Nehemiah Grew dari Inggris juga menjabarkan sel tumbuhan dalam tulisannya yang diterbitkan pada tahun 1682, dan ia berhasil mengamati banyak struktur hijau kecil di dalam sel-sel daun tumbuhan, yaitu kloroplas.
Teori sel
Dua ratus tahun kemudian, yakni sekitar tahun 1835, seorang ilmuan Prancis yang bernama Felix Dujardin meneliti bahwa sel-sel tersebut tersusun atas substansi berupa cairan. Cairan tersebut dikenal dengan istilah Protoplasma. Istilah Protoplasma kali ini dikemukakan oleh Johannes Purkinje.
Beberapa ilmuwan pada abad ke-18 dan awal abad ke-19 telah berspekulasi atau mengamati bahwa tumbuhan dan hewan tersusun atas sel, namun hal tersebut masih diperdebatkan pada saat itu. Pada tahun 1838, ahli botani Jerman Matthias Jakob Schleiden menyatakan bahwa semua tumbuhan terdiri atas sel dan bahwa semua aspek fungsi tubuh tumbuhan pada dasarnya merupakan manifestasi aktivitas sel. Ia juga menyatakan pentingnya nukleus (yang ditemukan Robert Brown pada tahun 1831) dalam fungsi dan pembentukan sel, namun ia salah mengira bahwa sel terbentuk dari nukleus. Pada tahun 1839, Theodor Schwann, yang setelah berdiskusi dengan Schleiden menyadari bahwa ia pernah mengamati nukleus sel hewan sebagaimana Schleiden mengamatinya pada tumbuhan, menyatakan bahwa semua bagian tubuh hewan juga tersusun atas sel. Menurutnya, prinsip universal pembentukan berbagai bagian tubuh semua organisme adalah pembentukan sel.
Yang kemudian memerinci teori sel sebagaimana yang dikenal dalam bentuk modern ialah Rudolf Virchow, seorang ilmuwan Jerman lainnya. Pada mulanya ia sependapat dengan Schleiden mengenai pembentukan sel. Namun, pengamatan mikroskopis atas berbagai proses patologis membuatnya menyimpulkan hal yang sama dengan yang telah disimpulkan oleh Robert Remak dari pengamatannya terhadap sel darah merah dan embrio, yaitu bahwa sel berasal dari sel lain melalui pembelahan sel. Pada tahun 1855, Virchow menerbitkan makalahnya yang memuat motonya yang terkenal, omnis cellula e cellula (semua sel berasal dari sel).
Perkembangan biologi sel
Antara tahun 1875 dan 1895, terjadi berbagai penemuan mengenai fenomena seluler dasar, seperti mitosis, meiosis, dan fertilisasi, serta berbagai organel penting, seperti mitokondria, kloroplas, danbadan Golgi. Lahirlah bidang yang mempelajari sel, yang saat itu disebut sitologi.
Perkembangan teknik baru, terutama fraksinasi sel dan mikroskopi elektron, memungkinkan sitologi dan biokimia melahirkan bidang baru yang disebut biologi sel. Pada tahun 1960, perhimpunan ilmiah American Society for Cell Biology didirikan di New York, Amerika Serikat, dan tidak lama setelahnya, jurnal ilmiah Journal of Biochemical and Biophysical Cytology berganti nama menjadiJournal of Cell Biology. Pada akhir dekade 1960-an, biologi sel telah menjadi suatu disiplin ilmu yang mapan, dengan perhimpunan dan publikasi ilmiahnya sendiri serta memiliki misi mengungkapkan mekanisme fungsi organel sel.
3. Bagian-Bagian Sel
a. Membran plasma
- Mengatur lalu lintas senyawa-senyawa atau ion-ion yang masuk dan keluar sel atau organel
- Sebagai reseptor (pengenal) molekul-molekul khusus (hormon) metabolit dll dan agensia khas seperti bakteri dan virus
- Tempat berlangsunya berbgai reaksi kimia seperti pada membran motokondria, kloroplas, retikulum endoplasma dan lain-lain,
- Membran plasma juga berfungsi sebagai reseptor perubahan lingkungan sel, seperti perubahan suhu, intensitas cahaya dan lain-lain.
b. Dinding sel
Fungsi dinding sel pada tumbuhan adalah untuk memperkokoh sel sebagaimana sel tulang pada hewan.
c. Sitoplasma dan nukleoplasma
Fungsi nucleolus adalah tempat perakitan ribosom.




 Jika besar percepatan sama dengan nol maka persamaan hukum II Newton berubah menjadi persamaan
Jika besar percepatan sama dengan nol maka persamaan hukum II Newton berubah menjadi persamaan